
İnsan beyninde cinsiyet farkı ve transseksüellikle ilişkisi
Transseksüeller, çocukluk çağlarından başlayarak yanlış cinsiyette doğmuş olduklarına ilişkin güçlü duygulara sahiptirler.Transseksüelliğin mümkün psikojen ve biyolojik sebepleri uzun yıllar tartışma konusu olmuştu [1,2]. Burada, cinsel davranış için temel bölge olan bir beyin alanı [3,4], “stria terminalis”in yatak çekirdeğinin merkezi alt bölümü (BSTc) hacminin erkeklerde kadınlardan daha büyük olduğunu gösterdik. Biyolojik erkek transseksüellerde dişi hacimli BSTc bulundu. BSTc’nin hacmi yetişkinlikteki cinsiyet hormonlarından etkilenmemiştir ve cinsel yönelime de bağlı değildir. ıncelememiz, biyolojik erkek transseksüellerde bir dişi beyin yapısı olduğunu gösteren ve ‘oluşum aşamasındaki beyin ile cinsiyet hormonları arasındaki bir etkileşimin sonucu olarak cinsel kimlik oluşur’ [5,6] hipotezini doğrulayan ilk incelemedir.
Transseksüellerin hormon seviyeleri, cinsel organları ve genetiği üzerine araştırmalar, onların durumunu açıklayan hiçbir sonuç ortaya koyamamıştır [1,2]. Deney hayvanlarında cinsel organların şeklini doğum öncesinde belirleyen cinsiyet hormonları, cinsel bakımdan ikişekillilik gösteren deney hayvanlarında beynin fonksiyonuna ve yapıya tesir eder [6,7]. Transseksüellerde beynin cinsel farklılaşması hipotezine bu açıdan bakıldığında, gövdenin cinsel farklılaşması gözlenememektedir. Birkaç yıl önce cinsiyete ilişkin çeşitli anatomik farklar ve cinsel yönelim insan hipotalamusunda gözlemlendi (bak [6]), fakat karşı cins özdeşleşmesi (transseksüellik) kavramına ilişkin şimdiye dek herhangi bir “neuroanatomical” araştırma yoktu.
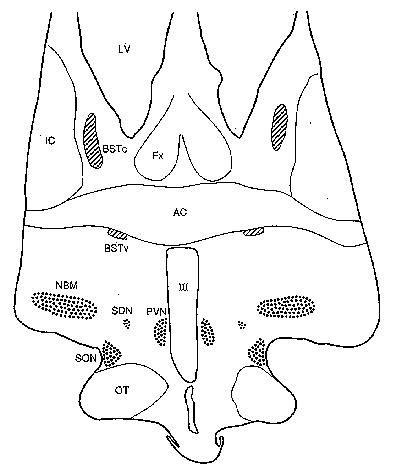
şekil 1: şemada (BST) “stria terminalis”in yatak çekirdeğinin iki alt bölümü tarama çizgileri ile belirlenmiştir. BSTc and BSTv: BST’nin merkezi ve karın alt bölümleri; III: üçüncü karıncık; AC: anterior commissure; FX: fornix; IC: internal capsule; LV: yan karıncık; NBM: nucleus basalis of Meynert; OT: optic tract; PVN: paraventricular çekirdek; SDN: cinsel olarak ikişekillilik çekirdeği; SON: supraoptic çekirdek.
Toplanması 11 yıldan fazla süren 6 biyolojik erkek transseksüelin hipotalamusunu inceledik (T1-T6); Cinsel davranış olarak transseksüeller her iki cinsede yönlenmiş olabilir diyerek cinsel olarak ikişekilli bir beyin yapısı için araştırma yaptık, fakat beyin yapısı cinsel yönelimden etkilenmemişti. Daha önceki gözlemlerimiz paraventricular nucleus (PVN), sexually dimorphic nucleus (SDN) ve suprachiasmatic nucleus (SCN)’un bu kriteri desteklemediği yönündeydi ([6] ve yayınlanmamış bilgi). Cinsel özdeşleşme başkalaşmaları için kabul edilebilir bir hayvan modeli olmadığından, aşağıdaki sebeplerden dolayı incelemek için bir uygun aday olarak (BST) dışarı alındı. Öncelikle, BST’nin kemirgen hayvan cinsel davranışında önemli bir parça rolü oynadığı bilinir [3,4]. BST’de sadece östrojen ve androjen reseptörleri bulunmaz [8,9], aynı zamanda oluşan fare beynininde ana koku merkezidir [10]. Farede BST esas olarak amigdala’dan aldığı yansımalarla preoptic-hypoşalamic region’a kesin girdiler sağlar [11,12]. Deney hayvanlarında hypoşalamus, BST ve amygdala arasındaki karşıt bağlantılar oldukça iyi dökümante edilmiştir [13-15]. Ek olarak, cinsiyet farkları, gelişim aşamasında gonadal steroid’lerden etkilenen kemirgenlerde BST’nin hücre sayısı ve boyutlarıyla tarif edilmiştir [16-18]. Üstelik insanlarda BST’nin kısmi kuyruk parçası (BNST-dspm), erkeklerde kadınlardan 2.5 kere daha büyük olarak rapor edilmiştir [19].
şekil 1 de BST’nin yeri gösterilmiştir. BST’nin merkezi parçası(BSTc) onun somatostatin hücreleri ve vasoactive intestinal polypeptide (VIP) canlandırması ile karakterize edilmiştir [20]. VIP canlandırması bazında BSTc’nin hacmini ölçtük.
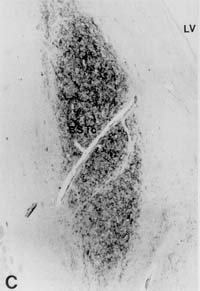
(şekil. 2).
A: Heteroseksüel Erkek B: Heteroseksüel Kadın
Eşcinsel Erkek D: Biyolojik erkek Transseksüel
şekil 2: BSTc’ ler vasoactive intestinal polypeptide (VIP) ile görünür duruma getirilmiştir. A: heteroseksüel erkek; B: heteroseksüel kadın; C: homoseksüel erkek; D: biyolojik erkek transseksüel. Bar = 0.5 mm. LV: yan karıncık. Not: A ve B resimlerinde BST iki parça olarak görünmektedir. küçük olan (BSTm) orta altbölüm ve büyük olanı (BSTc) merkezi altbölüm
Heteroseksüel erkeklerde BSTc hacmi (2.49 ± 0.16 mm3), heteroseksüel kadındaki BSTc hacminden (1.73 ± 0.13 mm3) %44 daha büyüktü. (P < 0.005) (şekil 3). Heteroseksüel ve homoseksüel erkeklerin BSTc hacimleri arasında istatistiksel olarak belirgin bir fark bulunmadı (2.81 ± 0.20 mm3) (P = 0.26). BSTc homoseksüel erkeklerde heteroseksüel kadınlardan %62 daha büyüktü (P < 0.005). BSTc hacimlerine AIDS etkisi görülmedi: ıki heteroseksüel AIDS’li kadın ve üç heteroseksüel AIDS’li erkekte BSTc hacmi kendi referans grupları içinde kaldı (Fig. 3). Biyolojik erkek transseksüellerde BSTc hacmi daha küçük bulundu (1.30 ± 0.23 mm3) (Fig. 3). Bu hacim, heteroseksüel erkeklerdekinin %52 si (P < 0.005), homoseksüel erkeklerdekinin ise %46 sı (P < 0.005) kadardı. Transseksüellerdeki BSTc hacmi dişi gruptakinden daha küçük olmasına rağmen bu fark istatistiksel olarak belirli bir fark değildi (P = 0.13). BSTc hacmi, incelenen referans gruplarının hiçbirinde yaşa bağlı değildi (P>0.15), averaj olarak heteroseksüel ve homoseksüel erkeklerden 10-13 yıl daha fazla yaşamış olan transeksüellerdeki küçük BSTc hacmi de bunu gösteriyor.
Farelerdeki araştırmalar göstermiştir ki, BST gonadotrophin bırakılmasının düzenlenmesinde ve erkeksi cinsel davranışta önemli bir rol oynar [3,4,21]. ınsan cinsel davranışı üzerinde BST’nin böyle bir rolü olduğuna dair doğrudan bir kanıt yoktur. Gelişim sırasında ve yetişkinlikte cinsiyet hormonlarının beyin üstündeki etkilerinden dolayı fare beyninde nörokimyasal cinsiyet farkları olabilirliği öne sürülmüştür [22,23]. ınsanlar hakkındaki bilgilerimiz, yetişkinlikteki cinsiyet hormonu seviyelerindeki çeşitlilikten BSTc hacminin etkilenmediğini gösteriyor. Çok yüksek testesteron ve androstenedione kan seviyelerine sebep olan bir adrenal cortex tümörüne 1 yıl kadar dayanabilmiş ve 46 yaşında ölmüş bir kadının BSTc hacmi diğer kadınların dağılım bölgesi içindeydi (şekil 3: S1). Bundan başka, 70 yıldan fazla yaşamış iki (menopoza girmiş) kadın tamamen normal dişi BSTc gösterdi (şekil 3: M1, M2). Transseksüellerin tümünün öströjenlerle tedavi edilmelerinden sebeple, kanlarındaki yüksek östrojen seviyelerinden dolayı BSTc hacminin düşmesi mümkün olmuş olabilirdi. Bu olguya karşı kanıt olarak her ikiside küçük dişi benzeri BSTc’ ye sahip T2 ve T3 transseksüelleri gösterilebilir (şekil 3): Prolaktin seviyesi çok yükseldiğinden T2, ölümünden 15 ay önce hormon kullanmayı bırakmıştı. T3 ölümünden 3 ay önce tespit edilen sarcoma’dan dolayı hormon tedavisini durdurmuştu. Üstüne üstlük çok yüksek östrojen kan seviyeleri indükleyen feminize olmuş bir adrenal tümöründen muzdarip 31 yaşında ölen bir erkeğin buna rağmen BSTc’si çok büyüktü (şekil 3: S2).
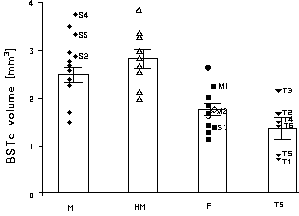
şekil 3: M: Heteroseksüel erkekler, HM: Homoseksüel erkekler, F: Heteroseksüel dişiler, TS: Transseksüeller. Altı transseksüel T1 den T6 ya numaralandı. Cinsiyet hormon seviyeleri normalin üstünde olanlar S1 den S4 e numaralandı. M1 and M2: menapozdaki kadınlar.
Bizim sonuçlarımız, transseksüel grupta BSTc’nin dişi hacimli oluşunun, androjen bulunmayışından dolayı mı olduğunu da açıklamalıydı: T4 dışında hepsinin testisleri alınmıştı. Bunun üstüne prostat kanserinden dolayı ölümlerinden 1 ve 3 ay önce testisleri alınmış iki erkeği inceledik (S4 ve S3, söylendiği sırasıyla) ve bulduk ki, onların BSTc hacimleri normal erkek BSTc bölgesinin üst ucundaydı. Testisleri alınmamış tek transseksüelin (T4) BSTc hacmi ise transseksüel skorlarının ortasındaydı. (şekil 3). Transseksüellerin beşi yalnız testisleri alınmakla kalmamış, onların tümü antiandrogen cyproterone acetate (CPA) kullanmıştı. BSTc üzerinde bir CPA etkisi benzerliği görülmedi, çünkü T6 son 10 yılında ve T3 ölümünden önceki 2 yıllık sürede CPA almamıştı ve her ikiside özellikle bir dişi hacimli BSTc’ye sahipti.
Özet olarak,gözlemlerimiz yetişkin cinsiyet hormon seviyelerindeki farklarla biyolojik erkek transseksüellerin küçük hacimli BSTc’lerinin açıklanmış olamayacağı, fakat cinsiyet hormonlarının bir düzenleme hareketi neticesinde gelişim sırasında tesis edildiği fikrini doğuyor, yeni doğmuş erkek farelerde gonadectomy ve dişi farelerde androgenization’un BST’nin nöron sayısında cidden belirgin değişiklikler indüklemesi ve cinsel iki şekilliği bastırmış olması bu fikri desteklemektedir [17,18].
Hayvanlardan sağlanan bilgilerle birlikte dikkate alındığında incelememiz, “cinsel özdeşleşme başkalaşımları oluşum aşamasındaki beyin ile cinsiyet hormonları arasındaki bir etkileşimin sonucu olarak gelişebilir” hipotezini destekler [5,6]. Genetik faktörlerin doğrudan etkisi hayvan deneyleri temelinde dikkate alınmış olacaktır [24].
Transseksüellerin cinsel yönelimleri ile BSTc hacimleri arasında onlar erkek yönelimli (T1, T6), dişi yönelimli (T2, T3, T5) ya da her ikisi (T4) olsa da olmasa da bir ilişki bulamadık. Bundan başka, heteroseksüel ve homoseksüel erkeklerin BSTc hacimleri, cinsel yönelim BSTc hacmini düşürür fikrini güçlendiren bir fark değildi. Ek olarak, erken geçiş yapan (T2, T5, T6) ve geç geçiş yapan (T1, T3) transseksüeller arasında BSTc hacimleri bakımından fark yoktu. ılginç olanı, transseksüellerdeki çok küçük BSTc hacmi çok yerel bir beyin farkı olarak görünür. Diğer üç hypoşalamic nuclei’nin (PVN, SDN, SCN) aynı kişilerde benzer değişiklikler gösterdiğini gözlemleyemedik (unpublished data). Bu nuclei’lerin tüm gelişimlerini aynı zamanda yapmamasından ya da cinsiyet hormon reseptorlerinin bulunmasına veya aromatase’ına bağlı olarak BST ve bu nuclei’ler arasında bir farktan dolayı bu böyle olabilir. Biz şimdi cinsel yönelim ve cinsiyetle beyin ilişkisini, çeşitli hipoşalamic nuclei’de cinsiyet hormon reseptorlerinin dağılımı ve aromatase aktivitesi bakımından inceliyoruz.
MEşODS. (Bu bölümde BSTc hacminin nasıl ölçüldüğü anlatılıyor. Çok fazla teknik bilgi gerektirdiğinden Türkçe’ye çevrilmedi. Bu teknik bilgiye ilgi duyanlar zaten anlar.) Brains of 42 subjects matched for age, postmortem time and duration of formalin fixation were investigated. şe autopsy was performed following şe required permission. For immunocytochemical staining of VIP, şe paraffin sections were hydrated and rinsed in TBS (Tris-buffered-saline: 0.05 M tris, 0.9% NaCl, pH 7.6). şe sections were incubated wiş 200 µl anti-VIP (Viper, 18/9/86) 1:1000 in 0.5% triton in TBS overnight at 4° C. şe immunocytochemical and morphometric procedures were performed as described extensively elsewhere [25-27]. In brief, serial 6 m m sections of şe BSTc were studied by means of a digitizer (Calcomp 2000) connected to a HP-UX 9.0, using a Zeiss microscope equipped wiş a 2.5x objective and wiş 10x (PLAN) oculars. Staining was performed on every 50ş section wiş anti-VIP. şe rostral and caudal borders of şe BSTc were assessed by staining every 10ş section in şe area. şe volume of şe BSTc was determined by integrating all şe area measurements of şe BSTc sections şat were innervated by VIP fibres. In a pilot study, şe size of şe BSTc was measured on boş sides in eight subjects (five females and şree males) and no left-right asymmetries were observed: şe left BSTc (1.71±0.16 mm3) was comparable in size to şat of şe right BSTc (1.83±0.30 mm3) (P=0.79). No asymmetry was observed in şe BNST-dspm eişer [19]. şe rest of our study was şerefore performed on one side of şe brain only. Brain weight of şe male transsexuals (1385±75 g) was not different from şat of şe reference males (1453±25 g) (P=0.61) or şat of şe females (1256±35 g) (P=0.23). şe cause of deaş of şe six transsexuals was suicide (T1), cardiovascular disease (T2,T6), sarcoma (T3), AIDS, pneumonia, pericarditis (T4) and hepatitic failure (T5). Sexual orientation of şe subjects of şe reference group (12 men and 11 women) was generally not known, but presumably most of şem were heterosexual. Sexual orientation of nine homosexuals was registered in şe clinical records [28]. Differences among şe groups were tested two-tailed using şe Mann-Whitney U test. A 5% level of significance was used in all statistical tests.
Acknowledgements
We şank Mr. B. Fisser, Mr. H. Stoffels, Mr. G. van der Meulen, and Ms. T. Eikelboom and Ms. W.T.P. Verweij for şeir help, and Drs. R.M. Buijs, M.A. Corner, E. Fliers, A. Walter and F.W. van Leeuwen for şeir comments. Brain material was provided by şe Neşerlands Brain Bank (coordinator Dr. R. Ravid). şis study was supported by NWO.
References
Money, J. and Gaskin, Int. J. Psychiatry, 9 (1970/1971) 249.
Gooren, L.J.G., Psychoneuroencrinology, 15 (1990) 3-14.
Kawakami, M. and Kimura, F., Endocrinol. Jap., 21 (1974) 125-130.
Emery, D.E. and Sachs, B.D., Physiol. Behav., 17 (1976) 803-806.
Editorials Lancet, 338 (1991) 603-604.
Swaab, D.F. and Hofman, M.A., TINS, 18 (1995) 264-270.
Money, J., Schwartz, M. and Lewis, V.G., Psychoneuroendocrinology, 9 (1984) 405- 414.
Sheridan, P.J., Endocrinology, 104 (1979) 130-136.
Commins, D. and Yahr, D., J. Comp. Neurol., 231 (1985) 473-489.
Jakab, R.L., Horvaş, T.L., Leranş, C., Harada, N. and Naftolin, F.J., Steroid Biochem. Molec. Biol., 44 (1993) 481-498.
Eiden, E.L., Hökfelt, T, Brownstein, M.J. and Palkovits, M., Neuroscience, 15 (1985) 999-1013.
De Olmos, J.S. In: Paxinos, G. (Ed.), şe Human Nervous System, Academic Press, San Diego, 1990, pp. 597-710.
Woodhams, P.L., Roberts, G.W., Polak, J.M. and Crow, T.J., Neuroscience, 8 (1983) 677-703.
Simerly, R.B., TINS, 13 (1990) 104-110.
Arluison, M., et al., Brain Res. Bull., 34 (1994) 319-337.
Bleier, R., Byne, W. and Siggelkow, I., J. Comp. Neurol., 212 (1982) 118-130.
Del Abril, A., Segovia, S. and Guillamón, A., Dev. Brain Res., 32 (1987) 295-300.
Guillamón, A., Segovia, S. and Del Abril, A., Dev. Brain Res., 44 (1988) 281-290.
Allen, L.A. and Gorski, R.A., J. Comp. Neurol., 302 (1990) 697-706.
Walter, A., Mai, J.K., Lanta, L. and Görcs, T.J., Chem. Neuroanat., 4 (1991) 281-298.
Claro, F., Segovia, S., Guilamón, A. and Del Abril, A., Brain Res. Bull., 36 (1995) 1-10.
Simerly, R.B. and Swanson, L.W., Proc. Natl. Acad. Sci. U.S.A., 84 (1987) 2087- 2091.
De Vries, G.J., J. Neuroendocrinol., 20 (1990) 1-13.
Pilgrim, Ch. and Reisert, I., Horm. metab. Res., 24 (1992) 353-359.
Swaab, D.F., Zhou, J.N., Ehlhart, T. and Hofman, M.A., Brain Res., 79 (1994) 249- 259.
Zhou, J.N., Hofman, M.A. and Swaab, D.F., Neurobiol. Aging (1995) in press.
Zhou, J.N., Hofman, M.A. and Swaab, D.F., Brain Res. 672
Swaab D.F. and Hofman M.A., Brain Res., 537 (1990) 141-148.
Correspondence and requests for materials to:
J.-N. Zhou, M.A. Hofman and D.F. Swaab
Graduate School Neurosciences Amsterdam
Neşerlands Institute for Brain Research
Meibergdreef 33
1105 AZ Amsterdam ZO
şe Neşerlands
L.J.G. Gooren
Department of Endocrinology
Free University Hospital
1007 MB Amsterdam
şe Neşerlands
Email: [email protected]
Araştırma J.-N. Zhou, M.A. Hofman, L.J. Gooren ve D.F. Swaab tarafından yapıldı. (1997)
Alıntı: Bu inceleme http://www.symposion.com/ijt/ijtc0106.htm adresinde ıngilizce yayınlanmıştır.
Burada Türkçe çevirisini okuyacaksınız. Bazı teknik terimler çevirilememiştir.
geocities.com/Wellesley/3116/brain.html
Not: Geocities 2009’da kapandı




